Su içerisinde çözündüğünde, H+ iyonu veren bütün bileşikler asit özelliklidir. Turnusol kâğıdını maviden kırmızıya döndürür, dile dokunulduğunda ekşi tat verirler.
Bünyesinde C atomu içeren asitlerin çoğu organik ( laktik asit, asetik asit ), diğerleri ise inorganik ( hidroklorik asit, sülfirik asit ) tir.
Suda çözündüğü zaman OH-iyonu veren bileşikler baz özelliktedir.
Turnusol kâğıdını kırmızıdan maviye çevirirler. Organik bazlar bünyelerinde genel olarak karbon ve azot bulundururlar.
Bir çözeltideki hidrojen iyonlarının derişiminin eksi logaritması çözeltinin asitlik ya da bazlık derecesini verir. Asitlik ve bazlık derecesi pH ile belirtilir. pH, sıfır ile 14 arası değerler alır.
Nötr çözeltide pH değeri 7’dir. 7’den küçük değerler asitliği, büyük değerler ise bazlığı ifade eder.
İnsan vücudunda değişik bölgelerin hatta hücre içerisinde belli alanların pH değerleri birbirinden oldukça farklıdır. Homeostazi prensibi gereğince canlılığın devam edebilmesi için bu pH değerlerinin korunması şarttır. Çünkü özellikle enzimler, belirli pH değerlerinde çalışabilirler ve pH değişimlerinden çabuk etkilenirler.
Örneğin insan vücudunda mide özsuyunun pH değeri 3 civarında iken, ince bağırsakta bu değer 8,5 civarıdır. Kanın normal pH değeri ise 7,4 civarında olup bu değerden sapmalar ölümle sonuçlanabilir.
Kan pH değeri insanda özel bir mekanizmayla dengede tutulmaya çalışılır. Kanda bulunan karbonik asit kanın pH değeri yükseldiğinde iyonlaşarak ortamı H+iyonlarınca zenginleştirir. Yani kan pH değerini normal seviyeye düşürür.
Kanın pH değeri aside doğru kaydığında ise bikarbonat iyonları hidrojen iyonlarını tekrar kendisine bağlar.
Yani karbonik asit, kanın pH değeri düştüğünde H+alıcısı, yükseldiğinde ise H+vericisi olarak görev yapmaktadır. Böylece kanın pH değişimlerini tamponlar.

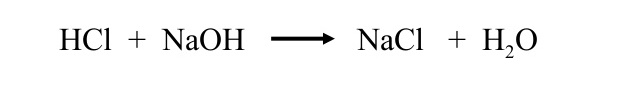
Asitlerle bazlar karıştırıldığında, asidin H+iyonu ile bazın OH-iyonu birleşerek bir molekül su açığa çıkarır. Asidin anyonu ile bazın katyonu ise birleşerek tuz oluşturur.
Hücre ve hücreler arası sıvıda çeşitli mineral tuzları bulunmaktadır. Sodyum, potasyum, magnezyum ve kalsiyum en önemli katyonları, klor, bikarbonat, fosfat ve sülfatlar ise en önemli anyonları oluşturmaktadır.